alles over osmium

Osmium - een zeldzaam metaal, behoort tot de platinagroep. Het werd ontdekt in Engeland als resultaat van experimenten met de reactie van platina. De naam osmium wordt in het Grieks gegeven en betekent in vertaling "geur". Hoe is dit edele metaal? Wat zijn de kenmerken en wat is het nut ervan?

Geschiedenis
De ontdekking van dit element gebeurde in 1803 per ongeluk door de Engelse scheikundigen Smithson Tennant en William H. Wollastan. Als resultaat van experimenten met de reactie van platina tot een mengsel van zuren (zwavelzuur en salpeterzuur), ontwikkelde het resulterende neerslag een onaangenaam aroma, dat doet denken aan de stank van chloor en rotte radijs. Soortgelijke experimenten werden uitgevoerd door Colle-Descoti, Antoine de Fourcoy en Vauquelin in Frankrijk. Als resultaat van hun onderzoek vonden ze ook een onbekende stof in het onoplosbare sediment van platina.



De toen onbekende stof heette kuiken, maar de experimenten van de Britten bewezen dat dit twee vergelijkbare stoffen zijn - iridium en osmium.
De ontdekking van deze chemische elementen werd aan de Royal Society in Londen gepresenteerd door Tennant's schriftelijke mededeling van 21 juni 1804. In het periodiek systeem van chemische elementen van Mendelejev bevindt het metaal zich onder het volgnummer 76. Het metaal komt in zijn pure vorm niet voor door goudklompjes, daarom wordt de chemische formule in opgeloste vorm gepresenteerd.


Het element wordt gewonnen uit secundaire grondstoffen als resultaat van zijn scheiding van iridium, platina, platina-palladiumertsen of koper- en nikkelertsen. De jaarlijkse productie van het hele element in de wereld is niet groter dan 1 ton.


Geboorteplaats
'S Werelds grootste afzettingen zijn het vermelden waard, zoals zones als Oeral gebergte en Siberië in Rusland, noordelijke staat Alaska en westelijke staat Californië in Amerika, Canada in Noord-Amerika, Colombia in Zuid-Amerika en sommige Zuid-Afrikaanse landen, Australië, Eiland Tasmanië... Momenteel wordt een aanzienlijke osmiumafzetting overwogen Bushwell-complex in Zuid-Afrika, wordt daar het grootste deel van de stof gewonnen. Rekening houdend met het feit dat de grootste afzettingen van het metaal zich in Zuid-Afrika bevinden, zijn de wereldprijzen voor dit zeldzame aardmetaal vrij hoog. Kazachstan wordt beschouwd als de enige grote exporteur van osmium-187 ter wereld. Hoewel China platina-ertsreserves heeft, heeft het geen significante hoeveelheden osmium.


De stof wordt in poedervorm opgeslagen en aangezien deze niet in de vorm van kristallen smelt, is het vanwege de fysieke eigenschappen niet mogelijk om er een stempel op te drukken. Voor de vervaardiging van ingots van dit metaal wordt gebruik gemaakt van elektronenstraal- of boogverwarming uit een poeder; verwarming in een smeltkroes wordt ook gebruikt.


Eigendommen
Osmium ziet eruit als een zilverachtig blauwachtig metaal. Het is een van de dichtste elementen, de dichtheid is 22.600 kilogram per kubieke meter, maar tegelijkertijd is de substantie vrij fragiel, breekt gemakkelijk en brokkelt af. Het heeft een hoog soortelijk gewicht en kan zelfs bij vrij hoge temperatuurinvloeden glanzen. Vanwege de parameters en de aanzienlijke smelttemperatuur is het moeilijk om het te bewerken. In de natuur bestaat het in de vorm van zeven isotopen, waarvan er zes als stabiel worden beschouwd, dit zijn osmium-184, osmium-187, osmium-188, osmium-189, osmium-190 en osmium-192. Radioactieve metaalisotopen met massagetallen van 162 tot 197 werden in het laboratorium verkregen en sommige nucleaire isomeren werden ook kunstmatig verkregen.
Osmium heeft door zijn kenmerken een nadelige invloed op alle levende organismen.

Vrijwel alle verbindingen met dit metaal veroorzaken schade aan inwendige organen, visuele en auditieve stoornissen. Bij vergiftiging met osmiumdampen kunnen onomkeerbare stoornissen in het lichaam en overlijden optreden. Wetenschappers voerden experimenten uit op dieren, met als resultaat de snelle ontwikkeling van bloedarmoede, het ontbreken van een normale longfunctie. Er werd geconcludeerd dat dit een zich snel ontwikkelend oedeem is. Osmiumtetroxide, dat in de geneeskunde wordt gebruikt, is een zeer bijtende stof. Heeft de smerigste geur ter wereld. In geval van vergiftiging lijdt de huid, deze verandert van kleur naar groen of zwart, vaak vergezeld van zweren en scheuren, die erg lang duren om te genezen.

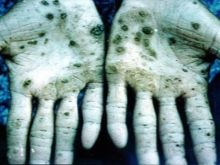

Medewerkers van productiefaciliteiten lopen het grootste risico; zij werken volgens alle veiligheidsnormen alleen met gasmaskers en speciale kleding. Alle containers met osmiumoxide worden verzegeld en volgens de regels opgeslagen. Om de mineralen van nevyanskiet te verkrijgen, wordt platina door middel van aqua regia omgezet in een oplossing. Vervolgens wordt het resulterende neerslag in een 8-voudige hoeveelheid blootgesteld aan zink - een dergelijke legering wordt relatief gemakkelijk omgezet in een poederachtige toestand, die vervolgens wordt versmolten met bariumperoxide. De volgende fase is de verwerking van de resulterende massa met koningswater, destillatie door het apparaat voor het scheiden van osmiumtetroxide.

Door in te werken op de stof met een alkalische oplossing, wordt zout verkregen. De zoutoplossing wordt beïnvloed hyposulfiet, waardoor het metaal met behulp van ammoniumchloride al neerslaat in de vorm van Fremy's zout. Het neerslag wordt gewassen, gefiltreerd en gecalcineerd. Het resultaat van al deze acties is sponsachtig osmium. Vervolgens wordt het met zuren gereinigd, in een elektrische oven onder een stroom waterstof gereduceerd en afgekoeld. Dus krijg osmiummonsters tot 99,9%.


Chemisch
De eigenschappen van dit element, vanuit het oogpunt van chemie, zijn verbluffend. De meest elementaire daarvan zijn de volgende.
- Osmium reageert helemaal niet met alkaliën en zuren. Vormt in water oplosbare osmaten in reactie met alkalische smelten. Interactie met een mengsel van salpeterzuur en zoutzuur geeft een extreem langzame reactie.
- Zeer giftig, zelfs in microscopisch kleine doses. Vooral giftig is osmiumoxide, dat vrijkomt uit platina.
- Het is onmogelijk om het kookpunt van het metaal te bepalen, omdat het bijzonder vuurvast is.
- Het metaal in het poeder gaat gemakkelijk een verhittingsreactie aan met dergelijke stoffen: zuivere zuurstof, halogenen, zwavelzuur of salpeterzuur.
- In verschillende verbindingen worden oxidegetallen van -2 tot +8 verkregen. De meest voorkomende zijn +2, +3, +4 en +8.
- In staat om clusterverbindingen te vormen.
- De belangrijkste mineralen zijn gerelateerd aan vaste oplossingen en worden vertegenwoordigd door legeringen van iridium met osmium - ze zijn sysertskiet en nevyanskiet. Bovendien heeft syserskite een andere naam - iridieus osmium en nevyanskiet - osmous iridium.

Fysiek
Dichtheid osmium is ongeveer 22,61 gram per kubieke centimeter. Kristallen hebben een mooie zilverachtige glans, met verschillende tinten van grijs tot blauw. In de blokken verschijnt een donkerblauwe kleur, in het poeder is het violet. Al het metaal heeft een zilverachtige glans. De toxiciteit van het element verhindert het gebruik ervan in de sieradenindustrie. De belangrijkste fysieke eigenschappen zijn als volgt.
- Het smeltpunt van dit element is vrij hoog, smelten is mogelijk bij temperaturen boven de 3000 graden Celsius.
- Metaal heeft geen magnetische eigenschappen.
- Verbazingwekkende stevigheid. Legeringen met de toevoeging van dit metaal krijgen een verhoogde slijtvastheid, duurzaamheid, corrosieweerstand en weerstand tegen mechanische belasting.
- Het kookpunt is 5012 ºC.
- Mohs-hardheid is 7.
- Vickers-hardheid is 3-4 GPa.

Toepassingen
Vanwege de aanzienlijke kosten van het element zelf, wordt dit metaal zelden gebruikt in industriële massaproductie. Osmium wordt voornamelijk gebruikt in de chemische industrie, waar het als katalysator wordt gebruikt. Osmiumtetroxide wordt in sommige geneesmiddelen gebruikt. In laboratoriumanalyses wordt het gebruikt voor het kleuren van levende weefsels, zorgt het voor het behoud van de celstructuur.
In de lucht- en ruimtevaartindustrie wordt osmium gebruikt in de elektronische uitrusting van apparatuur voor luchtvaart en rakettechnologie, evenals in de vervaardiging atoomwapens. Door het ontbreken van magnetische eigenschappen, het metaal wordt gebruikt bij de vervaardiging van merkhorloges zoals Rolex. Legering osmium met platina wordt gebruikt wanneer: creatie van chirurgische implantaten Zijn pacemakers of longkleppen.
Bovendien wordt osmium gebruikt in microscopie en om zeer nauwkeurige instrumenten te maken.



Interessante feiten
- Onder een druk van ongeveer 770 GPa in osmium interageren elektronen in interne orbitalen, de structuur van de stof blijft ongewijzigd.
- Osmium in de rotsen bevat een half procent van de totale massa ertsafzettingen.
- Door de hoge dichtheid het uiterlijk en het werkelijke gewicht van het metaal varieert sterk. Een plastic fles van 0,5 liter gevuld met dit metaalpoeder zal dus zwaarder zijn dan een emmer van 10 liter gevuld met water.
- Dit metaal staat in de vijf meest duur.
- De prijs van een driedubbele ounce osmium is een handelsgeheim, in open bronnen kun je een geschatte prijs vinden voor 1 gram van een stof.
- Vanwege de vuurvastheid van osmium opgemerkt in de geschiedenis van de elektrische lamp. Wetenschapper K. Auer von Welsbach uit Duitsland deed een voorstel om de koolstofgloeidraad in een gloeilamp te vervangen door een osmiumgloeidraad. De lampen bleken 3 keer minder energie-intensief te zijn en de verlichting is aanzienlijk verbeterd. Toegegeven, het werd al snel vervangen door het meer gebruikelijke tantaal, dat op zijn beurt werd vervangen door wolfraam.
- Een soortgelijke situatie deed zich voor met het zeldzame metaal in de ammoniakproductie. De nog steeds toegepaste methode van ammoniaksynthese, ontwikkeld in 1908 door de chemicus Fritz Haber uit Duitsland, is onmogelijk zonder het gebruik van katalysatoren.Aanvankelijk vertoonden de destijds gebruikte katalysatoren hun eigenschappen alleen in aanwezigheid van significante temperatuuromstandigheden en hadden ze geen hoog rendement, dus het zoeken naar een vervanging was zeer dringend. Wetenschappers van het laboratorium van de Hogere Technische School in Karlsruhe deden een voorstel om fijn verneveld osmium als katalytisch element te gebruiken. De testresultaten bevestigden dat dit idee de moeite waard is, de katalytische temperatuur is met meer dan 100 ºC gedaald en de afgifte van ammoniak is aanzienlijk toegenomen. Toegegeven, in de toekomst weigerden ze osmium, maar hij hielp bij het oplossen van zo'n belangrijk probleem.

Osmium en andere zeldzame en unieke metalen spelen belangrijke rol in verschillende industrieën... Zelfs met al zijn giftigheid redt het levens en de gezondheid van mensen.
Zie de volgende video voor meer informatie over osmium.








